
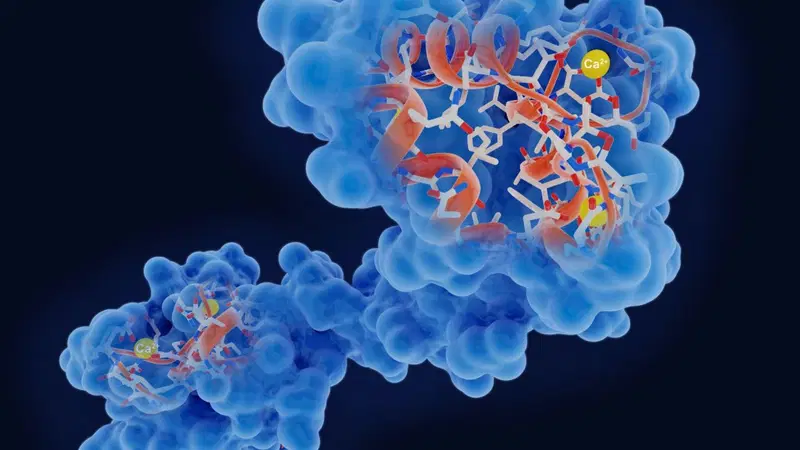
Las enzimas son proteínas complejas que producen un cambio químico específico. Actúan como catalizadores biológicos, acelerando dichas reacciones sin consumirse en el proceso. Son necesarias para todas las funciones corporales, véase la digestión (ayudan a descomponer los alimentos que consumimos para que el cuerpo los pueda usar), la producción de energía, la replicación del ADN y hasta la coagulación de la sangre.
Algunos ejemplos de enzimas son la amilasa (descompone los almidones en azúcares y está presente en la saliva y el páncreas), la pepsina (degrada proteínas en el estómago), ADN polimerasa (actúa en la replicación del ADN), la creatina quinasa (ayuda a los músculos a generar energía), o la lactasa (ayuda a digerir la lactosa en los productos lácteos).
Además de ser importantísimas para las funciones corporales, tienen una amplia variedad de usos en medicina y biotecnología: desde pruebas médicas, como detección de enfermedades hepáticas o cardíacas, hasta la producción de papel (la celulasa ayuda a mejorar su calidad y reciclaje), pasando por la producción de biocombustibles. Ahora, un grupo de científicos ha conseguido crear una enzima que se alimenta de residuos plásticos.
La inteligencia artificial para diseñar cosas que no se encuentran en la naturaleza

El polietileno tereftalato (PET) es un tipo de plásdtico muy utilizado en envases y textiles debido a su resistencia, ligereza y facilidad de reciclaje
El equipo de científicos a cargo del experimento consiguió la ruptura de un enlace éster, los cuales se forman uniendo dos cadenas de átomos de carbono mediante un átomo de oxígeno, y uno de los carbonos flanqueantes se une a un segundo oxígeno. Estos se pueden romper añadiendo una molécula de agua, lo que deja una cadena de carbono unida a un grupo de alcohol (COH) y la otra a un ácido orgánico (COOH).
Estos enlaces aparecen en diversas biomoléculas, de modo que muchas enzimas pueden manipularlos. Además, aparecen en una serie de polímeros plásticos que se utilizan a gran escala, por lo que la capacidad de romper los enlaces éster tiene un gran valor y potencial.
Para que las reacciones funcionen, todas las enzimas tienen un aminoácido clave que se encuentra en un punto crítico en relación con el pH típico de los seres vivos, lo que significa que puede extraer un protón del agua que lo rodea y donarlo a uno de los aminoácidos de la proteína. La simple ruptura de un enlace químico tiene, al menos, cuatro etapas distintas y requiere que se posicionen múltiples aminoácidos dentro del sitio activo de la enzima con precisión atómica.
Lo bueno es que la inteligencia artificial puede diseñar una proteína que tenga la configuración adecuada para realizar uno de estos pasos. Lo complicado es que pase por los cuatro. Los científicos empezaron utilizando herramientas estándar para manejar el diseño de proteínas, como RFDiffusion, que usa una semilla aleatoria para generar una variedad de fondos de proteínas.
Los investigadores pidieron a RFDiffusion que hiciera coincidir las posiciones promedio de los aminoácidos en una familia de enzimas que rompen ésteres. Los resultados introdujeron en otra red neuronal, que eligió los aminoácidos de manera que formaran un bolsillo que contuviera un éster que se descompone en una molécula fluorescente para que pudieran seguir la actividad de la enzima utilizando su brillo.
De las 129 proteínas diseñadas por el programa, solo dos de ellos resultaron en fluorescencia. Entonces, el equipo decidió que necesitaba otra IA más. Es donde entra en juego el software PLACER, que se entrenó tomando todas las estructuras conocidas de proteínas unidas a moléculas pequeñas y aleatorizando parte de su estructura, lo que obligó a la IA a aprender cómo cambiar las cosas de nuevo a un estado funcional.
Convertida en inteligencia artificial generativa, el número de enzimas con actividad catalítica aumentó más de tres veces. Por desgracia, todas esas enzimas se estancaron después de una sola reacción; no actuaron como catalizador. Esto llevó a los investigadores a usar PLACER para seleccionar estructuras que pudieran adoptar un estado intermedio, y produjo una tasa mucho mayor de enzimas reactivas.
Dos de ellas, llamadas «super» y «win», pasaron por múltiples rondas de reacciones, y el equipo consiguió, finalmente, crear una enzima. Los investigadores crearon una enzima que tenía actividad similar a algunas producidas por seres vivos reales, y demostraron que podían utilizar el mismo proceso para diseñar una esterasa capaz de digerir los enlaces del PET, un plástico común, como menciona el estudio.
El artículo Adiós a los residuos plásticos: un grupo de científicos consigue crear una enzima que se alimenta de ellos. Todo es gracias a la IA fue publicado originalmente en Urban Tecno.

Dejar una contestacion